Moření v HCl
Rubrika: Povrchová ochrana
Na povrchu oceli jsou přítomny oxidické vrstvy, vytvořené vzájemnou interakcí oceli a okolního prostředí. Utváření vrstev probíhá dvěma způsoby – oxidací za vyšších teplot (tvorba okují) a korozí. Tyto heterogenní reakce probíhají na rozhraní fází kov‑prostředí. V procesu zpracování oceli jsou oxidické vrstvy nežádoucí a odstraňují se procesem zvaným moření.
Moření je základní a nejrozšířenější chemický postup povrchové úpravy ocelí. Jde o odstranění vrstev anorganických oxidických sloučenin z kovových povrchů pomocí kapaliny, která oxidické vrstvy chemicky nebo elektrochemicky naruší a podpoří jejich odstranění. Při výrobě oceli navazuje moření na tvářecí procesy (válcování pásu a plechu za tepla a za studena, tažení drátu, trub a tyčí). Dále pak na žíhání a je rovněž základním postupem chemických předúprav povrchu oceli před nanášením galvanických povlaků a povlakováním roztavenými kovy (žárovým zinkováním, cínováním atd.). Uvádí se, že 60 – 70 % produkce vyráběné oceli se v průběhu výrobního cyklu alespoň 1 x moří v kyselinách. Pro představu v roce 2013 bylo na světě vyrobeno 1 582 miliónů tun oceli a mořeno bylo 950 – 1 100 miliónů tun.
K moření uhlíkatých, nelegovaných ocelí se v současnosti v Evropě používá převážně kyselina chlorovodíková (HCl) a méně (okolo 5 %) kyselina sírová (H2SO4).
1. VZNIK OXIDICKÝCH VRSTEV
1.1. Oxidace za vyšších teplot – tvorba okují
Většina kovů se při kontaktu se vzdušným kyslíkem pokrývá vrstvou oxidů. V první fázi dochází na povrchu kovu k chemisorpci atomů kyslíku. Sorbované atomy kyslíku přeměňují povrchovou vrstvu kovu v oxid železa. Rychlost tvorby okují je dána aktivační energií oxidační reakce a reakčními podmínkami (teplota, koncentrace reakčních složek atd.). Vzniklé vrstvy produktů na oceli nebrání dalšímu působení kyslíku na kov a ani dalšímu přemisťování iontů a elektronů ve vytvářené vrstvě okují.
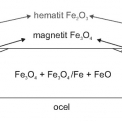
Okujová vrstva na nelegované oceli je povlak oxidů železa, vytvořený za vyšších teplot. Železo tvoří s kyslíkem tři stabilní oxidy – wüstit (FeO), magnetit (Fe3O4) a hematit (Fe2O3). Oxid železnatý, nejbohatší na kov, je nejblíže k povrchu kovu a oxid železitý, s nejmenším množstvím kovu, je nejblíže plynné fázi (Obr. 1). Řídícími procesy tvorby okuje jsou oxidace a difuze.
Oblasti termické stability jednotlivých oxidů popisuje stavový diagram železo – kyslík na obrázku 2. Z něj vyplývají oblasti teplotní stability pro jednotlivé oxidy železa. Do teploty 570 °C není stabilní FeO. Stabilní fází je Fe3O4 a rychlost oxidace je řízena tvorbou tohoto oxidu. FeO je pouze tenká vrstva bezprostředně na fázovém rozhraní železo/ oxid. Při teplotě do 500 °C přibývá α‑Fe2O3, který dominuje při teplotě 575 °C. Nad teplotou 570 °C se rychlost oxidace prudce zvyšuje a okuj tvoří z větší části FeO, ale obsahuje všechny tři oxidy. Nad FeO leží tenká vrstva Fe3O4, kterou překrývá ještě tenčí vrstva Fe2O3. FeO má zrnitou strukturu s četnými póry, Fe3O4 je ještě pórovitější a Fe2O3 je naopak kompaktní. Při teplotě nad 1 100 °C Fe2O3 zcela vymizí. Grafické znázornění změn složení okujové vrstvy na teplotě uvádí obrázek 3 a podíly jednotlivých oxidů v okujové vrstvě jsou uvedeny v tabulce 1.
Tabulka 1 – Podíl oxidů železa (hm. %) při různých teplotách
| Oxid | Teplota (°C) | |||
| 700 | 800 | 900 | 950 | |
| Fe2O3 | 1 | 0,75 | 0,96 | 0,78 |
| Fe3O4 | 5 | 4,1 | 4,3 | 4,4 |
| FeO | Zbytek | |||
Poměr obsahů jednotlivých oxidů závisí na složení oceli, tepelném zpracování, teplotě tváření a podmínkách chlazení. Pro difuzní koeficient železa platí, že je mnohem větší u wüstitu než u magnetitu a difuze kyslíku a železa přes vrstvu hematitu je velmi pomalá. Tomu odpovídá vzájemný poměr tlouštěk jednotlivých vrstev FeO : Fe3O4 : Fe2O3 100 : 10 : 1 resp. 100 : 5 : 1.
Složení okují vzniklých pří tváření může být rozdílné i u jednotlivých výrobků. Příkladem je za tepla válcovaný pás, kdy se složení okuje mění po šířce pásu. Důvodem je rozdílné chladnutí svitku a přístup kyslíku k okrajům pásu. Schematické rozložení oxidů pro pás chlazený na 600 °C znázorňuje obrázek 4.
1.2. koroze
Na vzduchu se, za přítomnosti absorbované vodní vrstvy, vytváří na povrchu oceli tenká vrstva korozních produktů (0,01 – 10 nm). Korozní produkty jsou složením v podstatě směsi hydroxidů železa. Primárně se tvoří Fe(OH)2 a dále oxidací Fe2O3. H2O nebo FeO(OH). Obecně jsou tyto produkty, díky své zásaditosti a volnější fyzikální struktuře, rozpustnější v mořicích kyselinách než oxidační produkty vzniklé za vyšších teplot.
2. ZÁKLADY MOŘENÍ
Moření není jednoduchý proces, nýbrž řada chemických, fyzikálních a elektrochemických dějů, probíhajích jak v heterogenních fázích tak homogenně v mořicích roztocích. Neprobíhají souběžně, ale jednotlivé děje synergicky vyvolávají další. Také produkty moření a legující prvky ovlivňují a iniciují další reakce.
2.1. Chemismus moření
Chemické děje rozpouštění okujové vrstvy v kyselinách lze popsat rovnicemi:
| FeO | + | 2 H+ | = | Fe2+ | + | H2O | (1) | ||
| Fe3O4 | + | 8 H+ | = | Fe2+ | + | 2 Fe3+ | + | 4 H2O | (2) |
| Fe2O3 | + | 6 H+ | = | 2 Fe3+ | + | 3 H2O | (3) | ||
| Fe(OH)3 | + | 3 H+ | = | Fe3+ | + | 3 H2O | (4) | ||
| Fe(OH)2 | + | 2 H+ | = | Fe2+ | + | 2 H2O | (5) | ||
| Fe | + | 2 H+ | = | Fe2+ | + | H2 | (6) | ||
| Fe | + | 2H+ | = | Fe2+ | + | 2 H | (7) | ||
| Fe3+ | + | H | = | Fe2+ | + | H+ | (8) | ||
| 2 Fe3+ | + | Fe | = | 3 Fe2+ | (9) |
U nelegovaných ocelí reaguje nejdříve mořicí roztok s oxidy železa a dalšími kovovými příměsemi celoplošně za tvorby solí. Tyto heterogenní reakce jsou chemické povahy. Přitom nejhůře rozpustná vrstva Fe2O3 brání rozpouštění dalších složek. Souběžně proniká mořicí roztok (ionty H+) póry ve vrstvě a vznikají lokální elektrochemické články se železem, vzniklým rozpadem wüstitu a oxidy a následně oxidy a kovovou matricí.
2.2. Elektrochemické děje
K popisu elektrochemických pochodů při moření se využívá analogie s galvanickým článkem. Je obecně známo, že každý kov jeví určitou snahu se rozpouštět, tedy uvolňovat do roztoku své kationty. Ponoříme-li do elektrolytu dva odlišné kovy (elektrody) a spojíme vnějším kovovým vodičem, dojde k vytvoření uzavřeného elektrického okruhu. Elektromorická síla vzniklého článku je závislá na obou kovech, rozdílu standardních potenciálů a množství iontů přenášejících elektrický náboj mezi anodou a katodou.
Hodnoty rovnovážných standardních potenciálů jednotlivých kovů uvádí tzv. Becketova řada napětí. Na levé straně jsou zařazeny ušlechtilé kovy s positivním potenciálem (např. Au, Pt, Pd ), které tvoří ionty obtížně a dají se snadno vylučovat z roztoku méně ušlechtilými kovy nebo plynným vodíkem. Na pravé straně jsou kovy neušlechtilé, s negativním rovnovážným potenciálem. Tato skupina má tendenci uvolňovat elektrony a tvořit kationty. Proto se tyto kovy rozpouštějí v kyselinách případně i ve vodě za vývoje plynného vodíku. Nulový standardní potenciál má vodíková elektroda, která formálně dělí kovy na ušlechtilé a neušlechtilé.
Rovněž nekovové fáze, pokud samy vykazují dostatečnou vodivost, mohou tvořit elektrody článků. V případě moření oceli vznikají lokální články mezi legujícím kovem a železem nebo také mezi železem a oxidem kovu. Tabulka 2 charakterizuje vlastnosti oxidů železa.
Wüstit má v pevné fázi nestechiometrické složení, kromě atomů Fe2+ obsahuje také Fe3+ a ve své krystalové mřížce má tedy méně atomů železa než kyslíku (Fe0,95O). Je tedy velmi defektní polovodič typu p. Celkový náboj kladně nabitých iontů železa v mřížce je stejný jako negativně nabitých iontů kyslíku. Třetí positivní náboj železitých (konfigurace d5) iontů není svázán s určitou posicí v mřížce, může přecházet na sousední ion a pohybovat se mřížkou. Tyto positivně nabité elektronové vakance umožňují pohyb náboje (vodivost) a wüstit tak vystupuje jako elektroda, transportující elektrický náboj.
U magnetitu se transportuje elektrický náboj tak, že mezi dvoj- a trojmocnými ionty železa probíhají přeskoky elektronů ve vazebných orbitech a způsobují jeho elektrickou vodivost. Je rovněž polovodičem typu p, ale s menší vodivostí než wüstit.
Hematit je prakticky nevodivý a tedy i nerozpustný a proto nemá pro elektrochemické pochody při moření žádný význam.
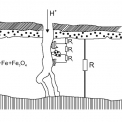
Studium mořicích procesů jednoznačně potvrdilo, že procesy probíhající při moření mají převážně elektrochemickou povahu. Mořicí roztok, který je silným elektrolytem, vstupuje do pórů a trhlinami v oxidické vrstvě a vytváří vodivá spojení s částicemi železa a následně s kovovou matricí (Obr. 5). Obnažená kovová matrice vytváří elektrochemické makročlánky s oxidy a vznikají kovové soli a vodík. Probíhají ale i reakce s doprovázejícími a legujícími prvky za tvorby nových chemických sloučenin, ale i reakce např. mezi reakčními produkty.
Wüstit a magnetit mají v kyselinách rovnovážné standardní potenciály (proti vodíkové elektrodě) +400 a +700 mV a chemicky se rozpouštějí jen velmi zvolna. Když se však vytvoří elektrické vodivé spojení mezi železem a oxidy v kyselém elektrolytu, pak na základě vytvořených lokálních článků Fe/FeO a Fe/Fe3O4 klesá potenciál na –180 až –230 mV (u Fe –250 mV). Tímto se významně zvyší rozpustnost oxidů (posun do neušlechtilé oblasti). U Fe2O3 v důsledku jeho izolačních vlastností nemá tato změna žádný význam.
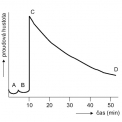
Na obrázku 6 vidíme změny proudové hustoty v průběhu moření. Úseky křivky charakterizují rozpouštění složek okuje.
Tabulka 2 – Charakteristiky oxidů obsažených v okujové vrstvě
| Oxid | Obsah O2 | Měrná el. vodivost | Spec. el. vodivost | Stand. potenciál |
| (hm. %) | (S.m-1) | (Ω-1.cm-1) | (mV) | |
| Wüstit | 22,27 | 0,01 | 1 | 440 |
| Magnetit | 27,64 | 1 - 10 | 100 - 1000 | 700 |
| Hematit | 60,05 | 10-5 | 10-3 | |
| Fe | - | 103 | - | - 250 |
3. PARAMETRY OVLIVŇUJÍCÍ MOŘENÍ
3.1. Složením okuje
Chemické složení oceli a okuje, dále její tloušťka a pórovitost zásadně ovlivňují mořitelnost oceli. Mořicí postup probíhá nejrychleji, pokud okuj obsahuje maximální množství wüstitu, určité množství magnetitu a minimálně hematitu.
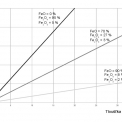
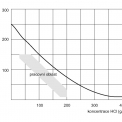
Prakticky to znamená, že nejlépe rozpustným oxidem v kyselinách je oxid s nejnižším mocenstvím kovu (nejvíce basický) – wüstit. Rozpustnost oxidů železa (obecně všech kovů) v kyselinách klesá s rostoucím mocenstvím kovu (roste acidita oxidů). Toto tvrzení dokládá obrázek 7. Tři druhy okují rozdílného chemického složení na povrchu za studena válcovaného pásu byly mořeny v kyselině solné a byla sledována doba moření. Nejdelší mořicí časy vykázala okuj obsahující nejvíce oxidů železa nejvyššího mocenství.
V praxi to rovněž znamená, že odstraněním oxidu železitého nebo předřazením operace snižující mocenství oxidu, dojde k urychlení moření. Urychlení se dosáhne také, když předřazený postup vytvoří v okuji póry, kterými mořicí kyselina pronikne k základní kovové matrici a vytvoří se makročlánky.
Z tohoto důvodu se před moření zařazují:
a) mechanické předúpravy – tryskání, lámání okuje, válcování s malým úběrem
b) chemické předúpravy – elektrolytické moření, moření v redukčních nebo oxidačních taveninách.
Zařazení procesu ale vyžaduje, aby byla zasažena celá plocha, tedy aby proces nebyl omezen pouze na část povrchu. Vhodným případem je kontinuální moření pásu a drátu, kde jsou procesy využívány.
Další faktory ovlivňující rychlost moření
Mimo složení okují ovlivňují rychlost moření i jiné faktory:
- předcházející technologické operace
- chemické složení oceli
- druh, koncentrace a čistota používané minerální kyseliny
- teplotě mořicí kapaliny a mořeného zboží
- obsahu kyslíku nebo jiného oxidačního činidla v mořicí kyselině
- pohyb mořeného zboží v mořicí kapalině případně pohyb a druh pohybu mořicí kapaliny na povrchu mořeného zboží
- použití mořicího inhibitoru
3.2. Vliv předcházejících technologických operací
Tloušťku a strukturu okuje ovlivňuje také tváření za tepla i za studena ve válcovnách pásu a tažírnách drátu a trub. Podle podmínek tvorby rozlišujeme okuj vzniklou po válcování a žíhání. Většinou platí, že okuj vytvořená za nevysokých tvářecích teplot je snáze mořitelná a rovnoměrněji odstranitelná než okuj po žíhání. Pro vytvoření okuje při tváření je rozhodující, jak rychle se ochladí zboží z teploty tváření na teplotu cca 300 °C, při které už další tvorba okuje neprobíhá.
Nejobtížněji mořitelné okuje po žíhání se tvoří tehdy, když žíhání probíhá v atmosféře bohaté na vodní páru. Okujová vrstva pak roste velmi pomalu a tvoří se hutné,
těsně přiléhající vrstvy špatně rozpustných oxidů. Mimo to je část oxidů redukována na kovy především reakcí s uhlíkem. Tvoří se pevně přilnavé vrstvy kov-oxid, které kladou odpor při napadení kyselinou.
Také fyzikální nehomogenitou látek, např. při tahovém nebo vnitřním napětí, dochází k rozdílům v rychlosti moření. Vlastní napětí snižuje standardní potenciál materiálu proti stavu bez napětí, což znamená, že rozpustnost daného materiálu stoupá s rostoucím napětím. Například za studena tažený drát má proti normální vodíkové elektrodě negativnější potenciál než žíhaný. Žíháním při teplotách mezi 600 – 800 °C mohou být vlastní napětí zcela nebo ve značné míře odstraněna.
3.3. Vliv chemického složení kovu na rychlost moření
Doprovodné a legující prvky v oceli ovlivňují rychlost moření. Zatímco čisté železo je obtížně rozpustné, u oceli se rozpustnost mění podle složení. Např. s rostoucím obsahem uhlíku roste a proto vysoce uhlíkaté oceli jsou velmi náchylné k přemoření. Křemík, mangan, fosfor, síra, měď stejně jako vodík – ovlivňují rozpustnost oceli v kyselinách. Síra, fosfor a mangan zvyšují rozpustnost ocelí v kyselinách.
Nejsilnější blokační účinek způsobuje měď. U ocelí, jejichž citlivost vůči kyselinám se zvyšuje v důsledku vyššího obsahu síry a fosforu, stoupající obsah mědi významně snížuje jejich rozpusnost. Působení je založeno na reakcích mědi s fosforem a sírou, kdy se tvoří sirník a fosfid mědi. Například u ocelích se legováním mědí (0,1 – 0,3%) snižuje rozpustnost v kyselinách o 30 – 90 %.
Malé obsahy křemíku až do 0,5 % nevykazují žádný vliv na napadení kyselinou; naproti tomu při koncentracích křemíku přes 10 % se tvoří slitiny Fe-Si, čímž se ocel stává takřka odolnou kyselině. Závěry platí pro nízkolegované oceli.
3.4. Druh, koncentrace a čistota použité anorganické kyseliny
Druh použité anorganické kyseliny, její koncentrace a čistota významně ovlivňují rychlost moření a kvalitu povrchu. Jestliže se dříve k moření nelegovaných ocelí používala převážně kyseliny sírová, tak skoro všechna nová zařízení pro moření plochých a dlouhých ocelových výrobků, předúpravy před galvanický povlakováním a před povlakováním roztavenými kovy, používají kyselinu solnou. Umožňuje použít pro všechny teploty vyšší rychlosti moření a tedy zvýšit produktivitu mořicí linky, kratší mořicí časy snižují hmotnostní úbytky, povrch po moření je prakticky bez mořicích kalů a může být totálně regenerována. Její nevýhodou je vyšší korozní napadání zařízení, nižší koncentrace nakupované koncentrované kyseliny a vyšší obsahy chloridů v oplachových vodách.
3.5. Vliv teploty mořicí kyseliny a mořeného zboží na rychlost moření
Teplota mořicí kyseliny a mořeného zboží ovlivňuje rychlost moření víc než obsah volné kyseliny. Se stoupající teplotou mořicí kapaliny případně mořeného zboží se zvyšuje rychlost moření, protože zvýšení reakční teploty způsobí nárůst reakční rychlosti. Vztah mezi specifickou rychlostí reakce a teplotou lze popsat Arrheniovou rovnicí:
k = k0 · Q / R · T (10)
kde:
k = specifická reakční rychlost
kO = molekulární konstanta
Q = aktivační energie reakce
R = universální plynová konstanta
T = absolutní teplota
Zvýšením teploty mořicího roztoku o 10 °C se rychlost moření zvyšuje 2 – 3x. Mimo zkrácení doby moření rostou ale s teplotou hmotnostní úbytky, exhalace a nároky na konstrukci zařízení. V praxi se teplota moření volí jako kompromis mezi výhodami a nevýhodami zvýšení teploty.
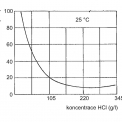
Obrázek 8 vystihuje závislost mezi dobou moření a koncentrací kyseliny chlorovodíkové při teplotě okolí a obrázek 9 pro dalších pět zvolených teplot. Hlavně při nižších koncentracích kyseliny chlorovodíkové a nižších teplotách se ukazuje potřeba takřka dvojnásobných mořicích časů. Rychlost moření i stupeň využití kyseliny lze zvýšit u lázní s nízkým obsahem chlorovodíku (pod 70 g/l) zvýšením teploty na cca 30 °C.
Obrázek 9 dokládá, proč velkokapacitní mořicí linky využívají teploty nad 50 °C. I při velmi nízkých obsazích volné kyseliny lze udržet dostatečnou mořicí rychlost a dosahovat obsah volné kyseliny v odpadní kyselině okolo 20 – 30 g/l.
Jak ovlivňuje rozpuštěné železo rychlost moření je uvedeno v obrázeku 10. Logicky se s růstem obahu železa snižuje rychlost moření. V praxi to opět znamená, v případě potřeby, využití vyšší teploty.
3.6. Obsah kyslíku a oxidačních činidel v mořící kyselině
Rozpouštění kovů v neoxidujících kyselinách je založeno na výměně náboje doprovázené vývojem vodíku. Při moření oceli probíhají dílčí reakce:
Fe → Fe2+ + 2 e- (11)
2 H+ + 2 e- → H2 ↑ (12)
Anodu tvoří kov, katodu, pokud nejsou k dispozici ušlechtilejší legující prvky, oxidické vrstvy na kovovém povrchu. Sumární rovnice pro výše uvedené dílčí reakce:
Fe + 2 H+ → Fe2+ + H2 ↑ (13)
Pokud vodík neuniká, ale oxiduje se ihned vzdušným kyslíkem nebo jiným oxidačním činidlem na vodu, posouvá se rovnováha sumární reakce doprava a nastává silné rozpouštění kovu. Tento pochod je označován jako depolarizace a oxidující činidlo jako depolarizátor.
Testy s kyselinou solnou a sírovou ukázaly, že přítomnost kyslíku za nižších teplot a nižších koncentrací kyseliny výrazně zvyšuje rychlost rozpouštění oceli. Kromě vzduchu nebo kyslíku působí i jiné oxidující sloučeniny, přičemž samy se vznikajícím atomárním vodíkem redukují. Oxidační činidla – chlorid železitý, chroman draselný, dusičnany, peroxid vodíku atd. byly a jsou úspěšně užívány jako urychlovače moření. Musí být ale doplňovány, protože se reakcí spotřebovávají. Vysoké koncentrace Fe3+ mohou v některých případech iniciovat lokální korozi.
3.7. Relativní pohyb mezi mořeným zbožím a proudící mořicí kapalinou
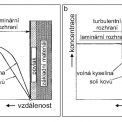
Při heterogenních reakcích, které probíhají při rozpouštění kovů v kyselinách, lze zvýšit rychlost probíhající reakce relativním pohybem mezi mořeným zbožím a mořicí kapalinou. Tím se vytvoří rozdílné transportní podmínky pro reakční produkty v hraniční vrstvě mezi kapalnou fází a povrchem kovu. Molekulární transport látek je řízen skrz laminární hraniční vrstvu. Ta je u nemíchaného mořicího média silnější než u médií s intensivním mícháním na kovovém povrchu. Změnou koncentračního gradientu mezi volnou kyselinou a korespondující kovovou solí a dosáhne se změny rychlosti moření.
Při turbulentním proudění v hraniční vrstvě je kyselina nasycená kovy na kovovém povrchu stále nahrazována čerstvou kyselinou, což vede k vyšší rychlosti moření. Obecně se zkracuje doba moření pohybem mořeného zboží nebo pohybem mořicího roztoku o 40 – 80 %. Při postřiku mořicího roztoku na mořené zboží je mořicí rychlost ještě vyšší. Obrázek 12 znázorňuje schematicky podmínky na rozhraní kov-mořicí kyselina pro případ nepohybující se a proudící mořicí kapaliny.
Vliv pohybu pásu (za tepla válcovaný, nízkouhlíkatá ocel) na dobu moření v kyselině chlorovodíkové za konstantních koncentračních podmínkách mořicí lázně a různých teplotách je znázorněn na obrázku 13.
3.8. Inhibitory moření
Účelem moření je odstranění okujové nebo korozní vrstvy. Mořením se však rozpouští i kovová matrice, což zvyšuje spotřebu kyseliny a dodatečné náklady na zpracování odpadů a roste nebezpečí difuze vodíku do kovové matrice. Proto se do mořicích kyselin přidávají látky podporující rozpouštění oxidů, aniž by současně zvyšovaly rozpouštění kovů – mořicí inhibitory. Ty redukují působení mořicí kyseliny na mořený základní materiál, brání zabudování vodíku do kovové mřížky a vzniku vodíkové křehkosti. Ochranné působení těchto látek je velmi rozdílné a závisí na koncentraci inhibitoru, složení, koncentraci a teplotě mořicí kyseliny a složení mořeného materiálu. Vyžaduje se chemická a teplotní stálost pro dané podmínky a inhibitory by neměly komplikovat regenerační postupy. Často se jedná o látky povrchově aktivní – smáčedla, emulgátory a jejich účinek je kombinovaný.
4. ZBYTKY PO MOŘENÍ
Kovové povrchy nejsou po moření úplně čisté, ale pokrývají je stopová množství nečistot, označovaná jako zbytky po moření. Tvoří je kovové soli vzniklé reakcí oxidické vrstvy, kovu a mořicí kyseliny a dále částečně v mořicích kyselinách nerozpustné doprovodné a legující prvky základní matrice, jako uhlík, fosfor, síra, měď, křemík, nikl atd.
Hromadění především ušlechtilých kovů ve zbytku po moření souvisí s jejich rozdílnou schopností k oxidaci. Předpokládá se, že ušlechtilé kovy se při moření nejdříve částečně rozpustí, pak se ale opět vyloučí na kovové matrici. Nerozpustné podíly uhlíku a ušlechtilých kovů obsažené v mořicích zbytcích jsou podstatně vyšší, než jejich podíly přešlé do roztoku. Elektricky nabité grafitové částice se vybíjejí na kovovém povrchu, ke kterému silně přilnou. Předpokládá se, že přilnavost grafitových zbytků po moření je podmíněna sloučeninami uhlovodíků, které mohou vznikat při moření uhlíkatých ocelí v mořicím roztoku. Protože ani oplach postřikem dostatečně neodstraní zbytky po moření, bývá často v mořírnách zařazován roztok alkalický roztok manganistanu draselného, který uvolněným kyslíkem většinu kalu uvolní.
V tabulce 3 jsou uvedena množství nerozpuštěné okuje na vzorcích za tepla válcovaného pásu po expozici v mořicích lázních různého složení s inhibitorem a bez inhibitoru. Porovnání bylo provedeno při třech teplotách.
Tabulka 3 – Porovnání doby moření (s) a množství nerozpuštěné okuje (g/m2) pro 3 mořicí kyseliny za teplot (30, 70 a 95 °C) . Testy byly provedeny bez inhibitoru a s inhibitorem. Podmínky měření: za tepla válcovaný pás cca 45 g okuje/m2, koncentrace kyseliny 20 % (každá hodnota je průměrem ze 30 měření).
| t (ºC) | Čas (s) | Hmotnostní úbytky (hm. %) | ||||
| HCl | H2SO4 | H3PO4 | HCl | H2SO4 | H3PO4 | |
| S inhibitorem | ||||||
| 30 | 158 | - | - | 0,43 | - | - |
| 70 | - | 195 | 190 | - | 6,26 | 0,04 |
| 95 | - | 59 | 69 | - | 1,44 | 0,02 |
| Bez inhibitoru | ||||||
| 30 | 194 | - | - | 0,24 | - | - |
| 70 | - | 251 | 227 | - | 5,04 | 0,06 |
| 95 | - | 68 | 75 | - | 1,23 | 0,02 |
Z tabulky 3 vyplývají zásadní rozdíly mezi mořením v HCl a zbylými dvěma kyselinami. HCl dokázala už za mírně zvýšené teploty odstranit takřka veškerou okuj. Kyselina sírová ani za nejvyšších teplot okuj zcela neodstranila. Množství nerozpuštěné okuje je při 95 °C ještě více než 3x větší než u kyseliny chlorovodíkové za mírně zvýšené teploty. Kyselina sírová zanechává i při nejvyšších teplotách okolo 3 % nerozpuštěné okuje. Použití inhibitorů přesně koresponduje s praktickými zkušenostmi. Bez inhibitorů jsou mořicí časy mírně kratší, povrch obsahuje více zbytků po moření. Nejsou zohledněny hmotnostní úbytky.
Tabulka 4 uvádí analýzy mořicích kalů u stejné oceli. Chemické složení je uvedeno v prvním řádku, v dalších řádcích pak obsahy prvků pro jednotlivé kyseliny.
Tabulka 4 – Složení kalů po moření na povrchu oceli
| složení oceli (%) | C | Mn | P | S | Cu | Ni | As | Fe |
| 0,04 | 0,32 | 0,03 | 0,01 | 0,18 | 0,08 | 0,04 | Zbytek | |
| H2SO4 | 4,7 | 0,27 | 0,88 | 1,08 | 20,4 | 2,36 | 3,81 | 49,56 |
| HCl | 5 | 0,28 | 1,44 | 0,18 | 20,18 | 7,23 | 6,73 | 41,1 |
Mořené povrchy ocelí poskytují v mnoha případech hrubší vrstvy než nemořené, přidání urychlovačů způsobuje, že tyto kaly mají jemnou krystalickou strukturu. Zbytky po kyselině sírové lpí na povrchu mnohem pevněji než po kyselině chlorovodíkové, které jsou méně objemné a snáze oplachovatelné.
LITERATURA:
[1] RAFAEL RITUPER: Beizen von Metallen, 1993
[2] JOSEF ŠTURC a kol.: Moření oceli, 1985
[3] VLADIMÍR ČÍHAL: Korozivzdorné oceli a slitiny, 1999
[4] WOLF, M.M., Scale formation and descaling in continuous casting and hot rolling , Iron & steelmaker, 2000
[5] YAO-NAN CHANG, FENG-I WEI, Hight temperature oxidation of low alloy steels, Journal of material science, 1989
[6] CHEN R.Y., YUEN W.Y.D., Review of the High-Temperature Oxidation of Iron and Carbon Steels in Air or Oxygen, Oxidation of Metalls, Vol. 59, No5/6, June 2003
[7] Werner Rausch: Die Phosphatierung von Metallen, 2005.